Bệnh viêm gan ruột truyền nhiễm hay còn gọi là bệnh Histomonosis hoặc bệnh đầu đen là một bệnh có tính lây lan ở gia cầm. Trong tự nhiên gà, gà tây, chim trĩ, chim công, chim cút, chim bồ câu, gà lôi, đà điểu, ngan, vịt,… đều có thể bị bệnh.

Triệu chứng
Triệu chứng sớm nhất có thể quan sát được của bệnh viêm gan ruột truyền nhiễm là gà đứng ủ rũ, ăn ít. Giai đoạn sau của bệnh, gà sốt 43 – 44oC, lười vận động, xù lông, sã cánh, đứng run rẩy, gà thường dấu đầu vào dưới cánh, hai mắt nhắm nghiền, gà uống nhiều nước. Khi mầm bệnh trong cơ thể nhiều gà bị tiêu chảy, phân màu vàng lưu huỳnh, da vùng đầu và mào tích nhợt nhạt, tái xanh hoặc xanh đen do rối loạn chức năng tiết mật và do chức năng của gan, thận bị suy yếu. Bệnh thường kéo dài 10 – 20 ngày nên gà rất gầy. Trước khi chết, thân nhiệt gà giảm xuống 39 – 380C.
Bệnh tích
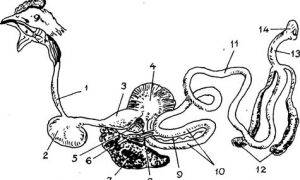
– Bệnh tích ở manh tràng
Sau khi xâm nhập vào cơ thể gia cầm qua đường ăn uống hay qua lỗ huyệt thì manh tràng là cơ quan đơn bào H. meleagridis ký sinh đầu tiên. Khi tới manh tràng, đơn bào bắt đầu sinh sản để tăng số lượng, sau đó xâm nhập vào niêm mạc và ký sinh ở đó. Số lượng đơn bào nhiều làm manh tràng bị viêm, thành manh tràng dày lên gấp nhiều lần. Dịch viêm, hồng cầu, bạch cầu, ký sinh trùng và chất chứa tích lại trong manh tràng tạo thành kén rắn chắc, màu trắng giống như pho mát.
– Bệnh tích ở gan
H. meleagridis từ manh tràng theo máu tới ký sinh ở gan và một số cơ quan khác trong cơ thể gia cầm. Ở gà tây, tổn thương gan bắt đầu vào ngày thứ 10 sau gây nhiễm: gan sưng to gấp 2 – 3 lần, viêm xuất huyết, hoại tử. Những ổ hoại tử có màu trắng ngà hoặc vàng nhạt, ban đầu nhỏ, lỗ chỗ như đá hoa cương, sau đó các ổ hoại tử mở rộng, đường kính lên tới 0,5 cm.
Chẩn đoán bệnh viêm gan ruột truyền nhiễm
Có rất nhiều phương pháp chẩn đoán, phát hiện bệnh ký sinh trùng nói chung và bệnh viêm gan ruột truyền nhiễm nói riêng. Cho đến nay, chẩn đoán bệnh dựa vào triệu chứng lâm sàng, kỹ thuật nuôi cấy, xét nghiệm phân để xác định hình thái đơn bào bằng kính hiển vi quang học, mổ khám kiểm tra bệnh tích vẫn là những phương pháp thường quy đang được ứng dụng rộng rãi.
– Chẩn đoán lâm sàng
Hiện nay, ở các cơ sở chăn nuôi, việc chẩn đoán đối với gà còn sống chủ yếu dựa vào các triệu chứng của bệnh: xù lông, sốt cao 43 – 440C, ăn ít hoặc bỏ ăn, lười vận động, đứng run rẩy, mắt nhắm nghiền và thường dấu đầu dưới cánh, da vùng đầu xạm màu, tiêu chảy phân màu vàng lưu huỳnh… Trong đó, triệu chứng điển hình nhất là gà tiêu chảy, phân màu vàng lưu huỳnh, da vùng đầu xanh xám, thậm chí xanh đen.
– Mổ khám gà ốm hoặc chết để kiểm tra bệnh tích.
+ Bệnh tích đại thể
Mổ khám xác chết hoặc con vật sống nghi bệnh, có thể phát hiện những biến đổi bất thường ở các cơ quan, phủ tạng để xét đoán nguyên nhân gây bệnh. Gà bị bệnh viêm gan ruột truyền nhiễm có bệnh tích đặc trưng tập trung chủ yếu ở gan và manh tràng: gan gà sưng to gấp 2 – 3 lần, bề mặt gan có những ổ hoại tử lỗ chỗ như đá hoa cương, hoặc ổ hoại tử hình hoa cúc màu trắng hoặc vàng nhạt; manh tràng bị viêm, sưng, thành manh tràng dày, trong manh tràng có kén trắng .
+ Bệnh tích vi thể
Đối với gia cầm ốm hoặc chết, ngoài mổ khám kiểm tra bệnh tích đại thể thì việc lấy mẫu các cơ quan nội tạng như gan, manh tràng để kiểm tra mô bệnh học sẽ giúp cho việc chẩn đoán chính xác hơn.
Tuy được sử dụng phổ biến, song các phương pháp nêu trên đều có hạn chế như: độ nhạy và độ đặc hiệu không cao, thời gian xét nghiệm kéo dài. Trong những năm gần đây, các phương pháp chẩn đoán mới như kỹ thuật ELISA, lai tại chỗ, PCR, hóa mô miễn dịch đã được ứng dụng trong
– Phương pháp PCR
Hiện nay, chẩn đoán bệnh viêm gan ruột truyền nhiễm bằng phương pháp PCR cho kết quả nhanh chóng và chính xác. Kỹ thuật PCR giúp tìm ra DNA của đơn bào H. meleagridis trong các mẫu mô và phân.
Huber K. và cs. (2005) đã nghiên cứu và thiết kế thành công quy trình PCR khuếch đại một đoạn DNA 209 pb nằm trong vùng 18S rRNA để phát hiện gen của H. meleagridis.
Hafez H. M. và cs. (2005) đã so sánh khả năng phát hiện H. meleagridis của các kỹ thuật PCR đó là: PCR thông thường, PCR lồng (nested PCR) và PCR định lượng (real-time PCR). Kết quả cho thấy, kỹ thuật PCR lồng có độ nhạy cao nhất, tiếp đến là PCR thường, thấp nhất là PCR định lượng. Tuy nhiên, kỹ thuật PCR định lượng lại có ưu điểm hơn so với PCR thường và PCR lồng, vì nó cho phép định lượng số bản copy DNA khởi đầu của khuôn mẫu với độ chính xác và độ nhạy cao, trên một phạm vi động học lớn.
Sử dụng phương pháp PCR, từ năm 2004 đến 2008, Hauck R. và cs. (2010) đã phát hiện được DNA của H. meleagridis trong 108/ 338 mẫu gan, manh tràng và một số khí quan khác thu thập từ gà tây, gà thịt và công nuôi tại Đức, nghi mắc Histomonosis.
Duc Tan Nguyen và cs. (2015) đã nghiên tỷ lệ nhiễm bệnh đầu đen trên 194 gà nuôi ở khu vực miền Nam Việt Nam. Sử dụng phương pháp PCR, tác giả đã xác định có 25,3% số gà kiểm tra dương tính với đơn bào H. meleagridis.
Các biện pháp phòng bệnh
* Vệ sinh phòng bệnh
Theo Nguyễn Xuân Bình và cs. (2002), đơn bào H. meleagridis gây bệnh có thể tồn tại 2 – 3 năm trong trứng của giun kim, gà ăn phải trứng giun kim có chứa H. meleagridis sẽ bị bệnh. Do đó, cần hạn chế cho gà tiếp xúc với đất, nên nuôi gà trên sàn.
Esquenet C. và cs. (2003) đã điều tra tình hình nhiễm đơn bào H. meleagridis trên đàn gà mái nuôi trong khu vực chuồng trước đó đã có gà nhiễm bệnh. Kết quả cho thấy, Histomonosis đã tái phát ở gà, tỷ lệ chết tăng 6%, sản lượng trứng giảm 11% so với lần nuôi trước đó. Theo tác giả, để đề phòng Histomonosis tái phát thì không nuôi nhiều lứa gà cùng lúc trong cùng một cơ sở chăn nuôi, thực hiện nuôi luân phiên gà trên các ô chuồng, tiến hành làm sạch, khử trùng tiêu độc ô chuồng vừa nuôi và phải để trống chuồng một thời gian dài.
Callait – Cardinal M. P. và cs. (2010) cho rằng, chuồng trại không đảm bảo vệ sinh, phân và rác ướt không thu dọn thường xuyên, thức ăn nước uống không sạch sẽ là những nguy cơ gây tái phát bệnh viêm gan ruột truyền nhiễm ở gia cầm.
* Sử dụng vắc xin phòng bệnh
Đã có nhiều nghiên cứu trên thế giới tập trung về phát triển vacxin phòng bệnh do H. meleagridis. Liebhart D. và cs. (2011) đã nghiên cứu sự thay đổi độc lực của đơn bào H. meleagridis khi cấy chuyển nhiều lần trong ống nghiệm. Sulejmanovic T. và cs. (2013) cũng làm thí nghiệm gây nhiễm đơn bào H. meleagridis nhược độc cho gà, gà tây bằng đường uống và bơm vào lỗ huyệt. Kết quả, gà không có triệu chứng lâm sàng hoặc tử vong khi công cường độc bằng đơn bào H. meleagridis liều 104 đơn bào. Do đó, kết quả thí nghiệm một lần nữa khẳng định, vấn đề sử dụng đơn bào H. meleagridis nhược độc chế tạo vắc xin phòng bệnh đầu đen cho gia cầm là một hướng đi mới đầy triển vọng.
Liebhart D. và cs. (2013) đã chế tạo vắc xin nhược độc phòng bệnh bệnh viêm gan ruột truyền nhiễm cho gia cầm. Tác giả đã thử nghiệm vacxin trên gà mái tơ 18 tuần tuổi, tuy nhiên đến thời điểm này vẫn chưa có vacxin hiệu quả cho công tác phòng chống bệnh này
Điều trị bệnh
Zenner L. và cs. (2003) đã nghiên cứu để đánh giá tác dụng của một số loại tinh dầu đối với đơn bào H. meleagridis ở gia cầm. Kết quả cho thấy, tinh dầu chiết xuất từ lá quế, vỏ quả chanh và củ tỏi có khả năng diệt đơn bào này trong ống nghiệm. Nồng độ gây chết tối thiểu (MLC) sau 24 giờ của tinh dầu quế đối với H. meleagridis là 0,5 µl/ ml; tinh dầu chanh và tinh dầu tỏi là 1 µl/ ml.
Hu J. và cs. (2004) đã thử nghiệm khả năng diệt đơn bào H. meleagridis của một số loại thuốc và cho biết, các thuốc dimetridazole, metronidazole, ornidazole và tinidazole có tác dụng ức chế sự tăng trưởng của H. meleagridis trong ống nghiệm ở liều ≥ 10 µg/ ml. Tiếp tục thử nghiệm thuốc trên gà bệnh, kết quả cho thấy, dùng thuốc dimetridazole, metronidazole, ornidazole và tinidazole trộn thức ăn với liều 200 ppm cho hiệu quả điều trị cao.
Arshad N. và cs. (2008) cho biết, hoạt chất alkaloid chiết xuất từ hạt của cây Peganum harmala (một loài cây lâu năm, dạng bụi, phân bố ở Trung Đông, Bắc Phi, và miền Nam châu Âu), có tác dụng ức chế sự phát triển của tất cả các vi khuẩn ở liều 0,38 – 1,55 mg/ ml và nguyên sinh động vật ở liều 0,63 – 1,65 mg/ ml.
Grabensteiner E. và cs. (2008) đã nghiên cứu và cho biết, các chất chiết xuất từ cây húng tây, cây cọ lùn, hạt nho và quả bí ngô có tác dụng ức chế sự phát triển của đơn bào H. meleagridis trong ống nghiệm.
Hauck R. và cs. (2010) đã nghiên cứu khả năng diệt đơn bào H. meleagridis trong ống nghiệm của tiamulin. Kết quả cho thấy, tiamulin làm giảm tăng trưởng của đơn bào H. meleagridis trong ống nghiệm ở nồng độ ≥ 20 ppm.
Thofner I. C. và cs. (2012) cho biết, chất artemisinin trong cây thanh hao hoa vàng có tác dụng ức chế sự phát triển của đơn bào H. meleagridis trong ống nghiệm (IC50 = 1,295 mg/ ml) nhưng không có hiệu quả điều trị Histomonosis trên gà.
Theo Bilic I. và cs. (2014), Hess M. và cs. (2015), thuốc nitroimidazoles và nitrofurans là 2 nhóm thuốc phòng, trị Histomonosis hiệu quả. Tuy nhiên, những năm 1990 các nhà quản lý thực phẩm, thuốc ở Bắc Mỹ, liên minh Châu Âu và nhiều nước khác trên thế giới đã có quyết định cấm sử dụng 2 sản phẩm này vì thuốc tồn dư lâu trong sản phẩm và gây ung thư cho người. Kể từ khi lệnh cấm sử dụng thuốc nhóm nitroimidazoles và nitrofurans, bệnh đầu đen lại tái xuất hiện. Vì không tìm ra hóa dược thay thế để điều trị nên hiện tại bệnh đầu đen lại bùng phát ở nhiều nước và gây thiệt hại nặng nề về kinh tế cho ngành chăn nuôi gia cầm trên thế giới. Do đó, việc nghiên cứu sử dụng đơn bào H. meleagridis nhược độc chế tạo vắc xin phòng bệnh và tìm ra phác đồ điều trị bệnh hiệu quả là những vấn đề cấp bách.
Nhóm NCM: Vắc-xin và chế phẩm sinh học
Nguồn: Học viện Nông nghiệp Việt Nam